Explicación del tema 8
Tema 8. Aldehídos y cetonas
Introducción
Un aldehído conjugado sensible a la luz tiene un papel muy importante en la química de la visión, tanto en vertebrados como en artrópodos y moluscos. En la retina del humano, el 11-cis-retinal se une a la opsina, que es una proteína y forman la rodopsina o púrpura visual. Cuando la luz es absorbida por la rodopsina, el 11-cis se isomeriza y la rodopsina cambia de forma y genera un impulso nervioso, lo que convierte la luz en señales eléctricas que se procesan en el cerebro generando una imagen; así es como funciona la vista, con química. Por eso, en este tema vamos a conocer a los aldehídos y también a las cetonas; su grupo funcional, cómo se nombran y sus propiedades y usos.
Explicación
8.1 Aldehídos
La característica de este grupo es el carbonilo C=O que también tienen las cetonas, la fórmula general es:
| R — CHO |
R – C = O | H |
Nomenclatura IUPAC
El carbonilo se encuentra al final de la cadena principal, es un carbonilo terminal y al nombrarlos no se necesita especificar su ubicación, pues siempre son terminales.
Para nombrar a un aldehído se escoge la cadena más larga que contenga el o los grupos aldehído, esta será la cadena principal y su nombre es igual al correspondiente alcano, alqueno, alquino o hidrocarburo cíclico con la terminación –al o –dial (si son dos).
| 3 2 1 CH3 – CH – CH = O | OH |
2-hidroxipropanal |
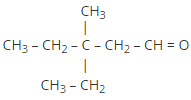 |
3-etil-3-metilpentanal |
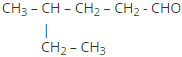 |
4-metilhexanal |
8.2 Cetonas
Presenta, igual que el aldehído, un grupo carbonilo C = O, la fórmula general es:
|
R – CO – R´ |
La diferencia con el aldehído es que el carbonilo en la cetona está en medio de las cadenas (carbono secundario) y en el aldehído es terminal (carbono primario).
Para nombrar a una cetona se escoge la cadena más larga que contenga el o los grupos cetona, esta es la cadena principal y el nombre es igual al correspondiente alcano, alqueno, alquino o hidrocarburo cíclico con la terminación ona, diona, triona, de acuerdo con la cantidad de carbonilos presentes en la cadena:
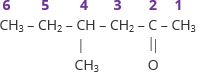 |
4-metilhexan-2-ona |
| CH3 – CH2 – CH – CO – CH – CH3 | | CH3 CH3 |
2,4-dimetilhexan-3-ona |
| CH3 – CH2 – CH – CO – CH2 – CH3 | CH3 |
4-metilhexan-3-ona |
| CH3 – CO – CH – CO – CH3 |
Pentano-2,4-diona |
8.3 Propiedades y repercusión en la industria y la vida cotidiana
Aldehídos
Solubilidad: son compuestos polares porque la diferencia de electronegatividades entre el carbono y el oxígeno del carbonilo es muy grande, por esta razón son solubles en agua y en solventes polares. Al aumentar la cadena principal de carbonos, disminuye la solubilidad en agua y en solventes polares.
Puntos de ebullición: tienen punto de ebullición entre los alcoholes y los éteres, por la atracción dipolo-dipolo del carbonilo, pero no forman puentes de hidrógeno. Observa la siguiente tabla:
Grupos funcionales |
Ejemplo |
Punto de ebullición |
Ejemplo |
Punto de ebullición |
Alcohol |
Propanol |
97.2°C |
Butanol |
117°C |
Aldehído |
Propanal |
49°C |
Butanal |
76°C |
Éter |
Oxapropano |
7.9°C |
Oxabutano |
39°C |
Usos
- Metanal: es el aldehído de un solo átomo de carbono, se le conoce también como formaldehído. Es un gas y, como es soluble en agua, se vende en soluciones al 40% con el nombre de formol; esta solución se utiliza para preservar cadáveres o cualquier pieza anatómica o biológica, se utiliza mucho para preparar resinas y baquelita, tinción de textiles, conservación de alimentos o para curtir pieles; es parte de la formulación de los desinfectantes.
- Etanal: también le llaman acetaldehído, tiene olor a frutas, a partir de este compuesto se elaboran polímeros, colorantes, espejos, resinas.
- 2-Propenal: acroleína, es muy tóxica, se utiliza para controlar plantas acuáticas y microorganismos como las bacterias, también se pueden fabricar polímeros con ella.
- Vainillina: saborizante, puede ser natural o sintética, da el sabor a la vainilla.
Cetonas
Solubilidad: por el grupo carbonilo son solubles en agua y en solventes polares, igual que los aldehídos; al aumentar la cadena de carbonos de la cadena principal, disminuye la solubilidad en agua, al disminuir la polaridad de la molécula.
Puntos de ebullición: son un poco más altos que los aldehídos correspondientes, observa la tabla de comparación.
Haz clic en cada palabra para revisar la información.
Grupos funcionales |
Ejemplo |
Punto de ebullición |
Ejemplo |
Punto de ebullición |
Alcohol |
Propanol |
97.2°C |
Butanol |
117°C |
Grupos funcionales |
Ejemplo |
Punto de ebullición |
Ejemplo |
Punto de ebullición |
Acetona |
Propanona |
56°C |
Butanona |
80°C |
Grupos funcionales |
Ejemplo |
Punto de ebullición |
Ejemplo |
Punto de ebullición |
Aldehído |
Propanal |
49°C |
Butanal |
76°C |
Grupos funcionales |
Ejemplo |
Punto de ebullición |
Ejemplo |
Punto de ebullición |
Éter |
Oxapropano |
7.6°C |
Oxabutano |
39°C |
Usos
En la naturaleza encuentras aldehídos y cetonas en:
- La fructosa (azúcar de frutas).
- Las hormonas como la progesterona, testosterona o cortisona.
- El alcanfor que tiene un olor muy característico.
- Las violetas, el compuesto que tienen es la ionona que le da su color.
- Perfumería, el compuesto que se usa es la muscona (principal componente del almizcle) y la civetona (olor a almizcle) que se obtienen de glándulas de animales.
- La industria la acetona (propanona) y la metil-etil cetona se usan mucho como disolventes, para los esmaltes de uñas y para las resinas de las uñas postizas.
Cierre
Los aldehídos y las cetonas se encuentran de forma natural en compuestos orgánicos como carbohidratos (azúcares) u hormonas. Todo esto forma parte de tu organismo. También los podemos hallar en productos que usamos a diario como las lociones y perfumes, ¡están en todas partes! Porque comúnmente son buenos solventes y algunos de estos compuestos tienen olores agradables; además de ofrecer la gran ventaja de que los de bajo peso molecular, son solubles en agua.
Checkpoint
Asegúrate de:
- Comprender la manera de nombrar aldehídos y cetonas según IUPAC.
- Relacionar las propiedades físicas de aldehídos o cetonas con sus usos y aplicaciones.